2025年07月25
揭示ZC4H2基因相关智力障碍的致病机理,并提出新的治疗靶点
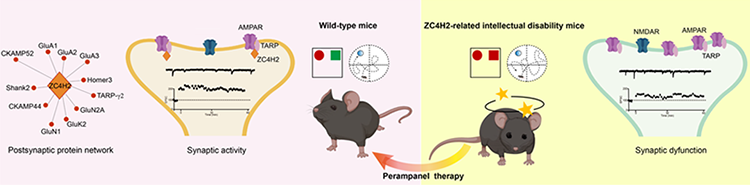
突触是大脑中神经元相互连接的结构和功能基本单元,突触活性紊乱和功能异常则是诸多脑疾病的重要致病机理,包括神经发育障碍和神经退行性疾病。然而,相关脑疾病致病基因引发突触功能异常的分子机制仍不甚清楚,靶向恢复突触活性是否可作为相关脑疾病的干预治疗手段,也有待深入研究。ZC4H2是一个X染色体连锁基因,其编码包含C4H2型结构的锌指蛋白,其基因突变会引发包括智力障碍、发育迟滞、运动障碍和癫痫等临床症状的神经发育障碍,目前此类疾病被称为ZC4H2相关罕见病(ZC4H2 associated rare disorder,ZARD)[1,2]。毛炳宇研究团队团队前期利用非洲爪蟾、斑马鱼和小鼠等动物模型,系统解析了ZC4H2在早期神经系统图式形成、小脑发育和骨骼发育过程中的重要作用与机制[3-7]。另外,虽然有研究提示ZC4H2可以定位到兴奋性神经突触,但其在突触活性和脑功能调节中的作用,以及遗传突变导致相关疾病,特别是智力障碍中的突触病理机制,仍缺乏相关研究。
中国科学院昆明动物研究所毛炳宇、盛能印与福建医科大学陶武成团队深入合作,基于前脑兴奋性神经元特异性敲除ZC4H2基因构建相关智力障碍的小鼠疾病模型,发现ZC4H2作为突触后定位分子,在兴奋性突触后形成分子调控网络,参与调节AMPA受体蛋白稳定性和和突触定位表达,其缺失引发大脑认知功能紊乱。该项研究于近日以The pathogenic factor of ZC4H2-associated rare disorder is a postsynaptic regulator for synaptic activity and cognitive function为题发表在《美国国家科学院院刊》(PNAS)杂志上。
研究团队首先构建了前脑兴奋性神经元特异性敲除ZC4H2的小鼠模型(ZC4H2-cKO),发现这些小鼠的认知、空间和社交记忆等大脑高级认知功能受损,表现出与ZARD患者相似的智力障碍的临床症状。研究团队进一步的电生理实验发现,ZC4H2缺失导致AMPA受体介导的微小兴奋性突触电流(mEPSC)的振幅和频率及刺激性兴奋性突触电流(eEPSC)均显著性增强,长时程增强LTP能力显著减弱。然而,ZC4H2缺失对NMDA受体介导的突触电流和GABA受体介导的抑制性突触电流(IPSC)都没有显著影响。
为了进一步解析ZC4H2调控突触功能的分子机制,研究团队通过体内TurboID邻近标记技术,绘制了神经元细胞中ZC4H2蛋白的互作网络,发现与ZC4H2相互作用的蛋白主要富集在兴奋性谷氨酸突触、RNA结合与代谢、核糖体与蛋白合成和细胞骨架与激酶等主要生物学过程。其中,多个突触后受体/骨架分子,如GluA1/2、GluN1/2A、Homer3和Shank2等,在ZC4H2参与的兴奋性谷氨酸突触蛋白网络中,这提示ZC4H2是一个突触后定位分子,直接参与突触功能的调控。研究团队的体内外生化实验证明,ZC4H2敲除特异增加突触后膜AMPA受体GluA1/2蛋白的水平,且ZC4H2直接与AMPA受体分子GluA1和GluA2相互作用,并通过影响其泛素化修饰,参与其蛋白稳定性的调控。
基于上述发现,研究团队尝试使用临床获批的AMPAR拮抗剂吡仑帕奈(Perampanel)治疗ZC4H2cKO小鼠高级认知功能受损的行为表现。结果显示,吡仑帕奈可显著降低ZC4H2 cKO小鼠异常的突触传递活性,并能恢复其社交记忆和空间记忆能力,有效改善了该小鼠受损的高级认知功能。该发现为ZARD的临床治疗提供了直接依据,并提示AMPAR靶向药物在智力障碍干预中的潜在价值。
综上,该研究阐明了ZARD相关智力障碍的突触致病机理,发现ZC4H2是通过调节AMPA受体蛋白稳定性和兴奋性突触活性以发挥作用,而Perampanel可以抑制ZC4H2功能丧失导致的突触活性异常增强,可以干预治疗相关认知功能损失。另外,值得一提的是,已报道有数十种ZC4H2蛋白错义突变导致ZARD疾病的发生,关于这些突变是如何影响ZC4H2蛋白的功能而导致疾病发生的精准致病机理及其靶向治疗的探索仍有待进一步的研究。
图示ZC4H2调控神经突触活性作用机制及ZARD相关智力障碍的致病机理
中国科学院昆明动物研究所马鹏程副研究员、盛能印研究员、毛炳宇研究员和福建医科大学陶武成教授为本文的共同通讯作者,福建医科大学基础医学院博士后万梨博士和中国科学院昆明动物研究所李雨薇助理研究员为本文的并列第一作者。该研究得到了国家重点研发计划、国家自然科学基金及云南省科技计划等项目的支持。
论文链接:doi: 10.1073/pnas.2426375122。
参考文献:
1. Hirata H,Nanda I,Riesen AV,et al. (2013) ZC4H2 mutations are associated with arthrogryposis multiplex congenita and intellectual disability through impairment of central and peripheral synaptic plasticity. Am J Hum Genet 92(5):681-95
2. May M,Hwang KS,Miles J,et al. (2015) ZC4H2,an XLID gene,is required for the generation of a specific subset of CNS interneurons. Hum Mol Genet24(17):4848-61
3. Ma P,Ren B,Yang X,et al. (2017) ZC4H2 stabilizes Smads to enhance BMP signalling,which is involved in neural development in Xenopus. Open Biol7(8):170122
4. Ma P,Song NN,Cheng X,et al. (2020) ZC4H2 stabilizes RNF220 to pattern ventral spinal cord through modulating Shh/Gli signaling. J Mol Cell Biol12(5):337-344
5. Song NN,Ma P,Zhang Q,et al. (2020) Rnf220/Zc4h2-mediated monoubiquitylation of Phox2 is required for noradrenergic neuron development. Development147(6):dev185199
6. Li Y,Yang C,Wang H,et al. (2022) Sequential stabilization of RNF220 by RLIM and ZC4H2 during cerebellum development and Shh-group medulloblastoma progression. J Mol Cell Biol 14(1):mjab082
7. Zhu L,Zhang L,Cha J,et al. (2024) Loss of ZC4H2,an Arthrogryposis Multiplex Congenita Associated Gene,Promotes Osteoclastogenesis in Mice. Genes (Basel) 15(9):1134