

在乳腺癌中,基底型ERa/PR/HER2三阴性乳腺癌恶性程度最高,占病人15%左右,具有较高的侵袭性,预后不良,目前还没有有效的靶向药物治疗,是乳腺癌研究的热点和难点。陈策实研究员领导的肿瘤生物学实验室通过多年研究证实KLF5在三阴性乳腺癌中高表达,促进乳腺癌细胞增殖、生存和迁移,是三阴性乳腺癌一个潜在治疗靶点。然而,KLF5作为一个转录因子不是药物直接作用的理想靶标,找到正向调控KLF5表达的酶作为抗癌药物靶点具有重要价值。
KLF5已知经历各种翻译后修饰包括泛素化。泛素化和去泛素化修饰所导致的蛋白降解的动态平衡在KLF5蛋白水平的调节中具有重要地位。大多数重要的转录因子如p53、c-Myc、HIF1a和β-catenin等都受到泛素化/去泛素化调节,KLF5也不例外。学科组前期研究发现E3泛素连接酶WWP1和SCFFbw7促进KLF5泛素化降解,而能够特异性去除KLF5蛋白的多聚泛素化修饰、维持KLF5蛋白稳定性的去泛素化酶分子还知之甚少,学科组最近研究发现去泛素化酶ATXN3L能够增加KLF5蛋白稳定性,但是ATXN3L内源蛋白在乳腺癌无法检测到,而且它体外促进肿瘤的功能不是很明显,体内功能没有研究。
肿瘤生物学课题组博士生秦君英在陈策实研究员指导下通过筛选去泛素化酶siRNA文库发现BAP1是一个能够明显增加KLF5稳定性的去泛素化酶。BAP1最早认为是一个BRCA1相互作用蛋白,近年来BAP1在肿瘤中研究报道甚多,它的基因突变频繁发生在葡萄膜黑色素瘤、间皮瘤和肾癌等肿瘤,从这些遗传数据推测BAP1可能是一个抑癌基因,但是在乳腺癌BAP1很少突变,BAP1功能研究结果很不一致,有人发现BAP1抑制肿瘤,另外却有人报道它促进肿瘤,所以BAP1在乳腺癌的功能亟待阐明。
研究发现BAP1和KLF5蛋白直接相互作用, BAP1显著增加KLF5蛋白的稳定性,这种作用是通过BAP1对KLF5的去泛素化来实现的。BAP1还和KLF5、HCF1等蛋白形成一个转录复合物,结合到下游靶基因如p27的启动子抑制其转录,从而促进细胞周期进展和细胞增殖。敲低BAP1或者KLF5表达都会抑制三阴性乳腺癌细胞在裸鼠体内生长和肺转移。研究证实BAP1发挥这些作用至少部分通过稳定KLF5实现的。这项研究首次阐明BAP1在乳腺癌中的促癌功能和作用机制,为三阴性乳腺癌的治疗提供了新的靶点。
该项工作于2015年9月30日在线发表在Nature子刊《Nature Communications》。(论文链接: http://www.nature.com/ncomms/2015/150930/ncomms9471/full/ncomms9471.html)。秦君英单独第一作者,陈策实研究员为唯一通讯作者,该研究项目得到了中科院干细胞先导专项、国家自然科学基金、科技部973项目的资助。
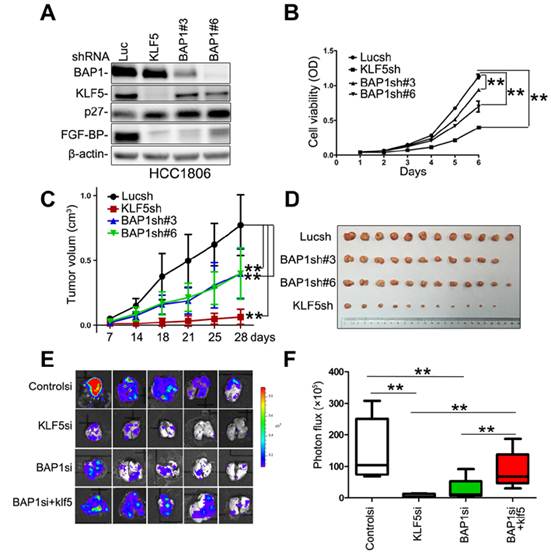
图注:在三阴性乳腺癌细胞中敲低去泛素化酶BAP1表达降低KLF5蛋白表达水平,调节KLF5下游靶基因表达,抑制癌细胞在体外和体内的生长和转移,恢复KLF5表达可以抑制BAP1敲低引起的表型。
