2025年09月23
赖仞团队发现人体内源抗菌肽新功能:Cathelicidin抗菌肽调控低密度脂蛋白-胆固醇代谢
胆固醇代谢紊乱是心血管疾病与代谢功能障碍相关脂肪性肝病(MASLD)的共同致病因素。低密度脂蛋白(LDL)是运输内源性胆固醇的主要载体,如何安全有效地促进低密度脂蛋白-胆固醇(LDL-C)清除一直是代谢领域的研究重点。
中国科学院昆明动物研究所赖仞研究员团队的前期系列工作证实Cathelicidin抗菌肽LL-37在高脂饮食诱发的动脉粥样硬化炎症激活中发挥着至关重要的作用(Immunity. 2015, 43:1137-47)。近期有研究表明,LL-37可能参与调控巨噬细胞等对脂蛋白的摄取过程,但LL-37能否直接与LDL发生相互作用,以及此种相互作用在全身性胆固醇代谢稳态中的生理功能与分子机制尚待研究。
赖仞研究员团队联合加拿大多伦多大学倪合宇教授团队研究发现:Cathelicidin抗菌肽LL-37直接结合LDL及其核心载脂蛋白B-100(ApoB-100),促进肝细胞对LDL的摄取和清除,从而缓解高脂高胆固醇饮食引起的肝脏脂肪积聚。
该研究综合运用多种技术手段,首次证实人源Cathelicidin抗菌肽LL-37能高亲和力地直接结合LDL及其核心载脂蛋白ApoB-100,显著增强ApoB-100在溶液中的可溶性并提高其α-螺旋含量,从而稳定LDL颗粒的天然构象。研究团队进一步研究发现LL-37能够增强LDL与LDL受体(LDLR)的亲和力,并借助LDLR途径促进肝细胞对LDL的高效摄取。LL-37-LDL互作引起胞内胆固醇水平瞬时上升,激活肝X受体(LXR)信号通路,驱动胆固醇转化为胆汁酸并经粪便排出,实现胆固醇清除。这一发现揭示了一条由内源性抗菌肽LL-37介导的、从胞外摄取到胞内核受体信号激活再到胆汁排泄的完整胆固醇逆向转运新路径。
2025年9月,该研究成果以“Cathelicidin LL-37-ApoB-100 interaction promotes LDL clearance and attenuates cholesterol accumulation in the liver”为题在线发表于SCIENCE CHINA Life Sciences(中国科学生命科学)。中国科学院昆明动物研究所赖仞研究员、加拿大多伦多大学倪合宇教授为本文的共同通讯作者;中国科学院昆明动物研究所房亚群博士(助理研究员)、张治业博士(现为中国医学科学院医学生物学研究所研究员)、曹奇奇硕士毕业生、王淦博士(现为中国科学院成都生物研究所研究员)为本文的共同第一作者。
该研究得到来自国家自然科学基金委、国家重点研发计划、云南省科技厅、新基石研究员以及昆明市科技局等项目的资助。
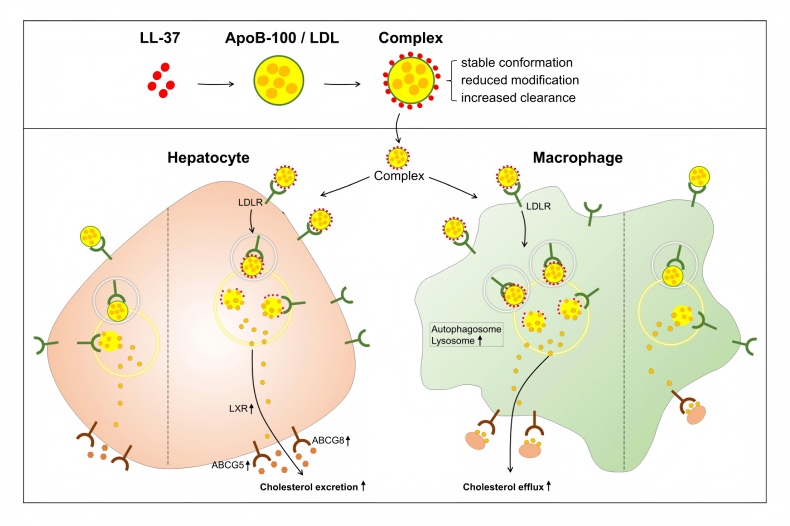
LL-37是低密度脂蛋白-胆固醇代谢的内源性调控分子
文章链接:https://www.sciengine.com/SCLS/doi/10.1007/s11427-025-3006-2