

三阴性乳腺癌 (TNBC) 缺少雌激素受体 (ER) 、孕激素受体 (PR) 和人表皮生长因子受体2 (HER2)的表达,是恶性程度高、易转移、高复发和预后差的一类乳腺癌。由于缺乏有效的治疗靶点,化疗是TNBC主要的治疗方式之一,然而化疗药物能够杀死正在分裂的肿瘤细胞,却不能有效作用于肿瘤干细胞,从而导致肿瘤干细胞的富集,进而产生TNBC的耐药性。因此由肿瘤干细胞介导的耐药性是TNBC治疗的研究难点之一。
结合TNBC单细胞测序数据,课题组鉴定了一个在乳腺癌干细胞(BCSC)中高表达的基因-SGCE。表型分析发现SGCE对于乳腺癌干细胞的自我更新不可或缺。在机制探讨上,发现SGCE与E3泛素连接酶c-Cbl相互结合,SGCE缺失促进c-Cbl释放出来而泛素化其底物蛋白EGFR,从而使得EGFR进入网格蛋白介导和巨胞饮途径的内化,内化的EGFR进而进入溶酶体降解。EGFR的降解导致其下游通路被阻断并最终抑制BCSC自我更新和胞外基质ECM的累积。SGCE在BCSC中高表达时,SGCE与c-Cbl相互结合,EGFR能够正常激活其下游信号通路PI3K-AKT,促进BCSC干性维持、肿瘤细胞迁移、化疗药物和靶向EGFR抑制剂的耐药性(如图1所示)。
EGFR在超过50% TNBC病人中高表达,与乳腺癌细胞增殖、转移和BCSC的干性维持密切相关,然而EGFR的抑制剂(如吉非替尼和拉帕替尼)在乳腺癌中的临床治疗效果并不显著。SGCE分子帮助维持BCSC中EGFR高表达,去除SGCE的表达则可以促进TNBC中的EGFR靶向治疗的效果,从而为EGFR与其它靶点的联合治疗提供新策略。
该项研究成果近期发表在Advanced Science期刊上。在线链接https://onlinelibrary.wiley.com/doi/full/10.1002/advs.201903700。中科院昆明动物所的赵丽娜、邱婷和蒋德伟为该文的共同第一作者。中科院昆明动物所的焦保卫和陈策实研究员为该文的共同通讯作者。
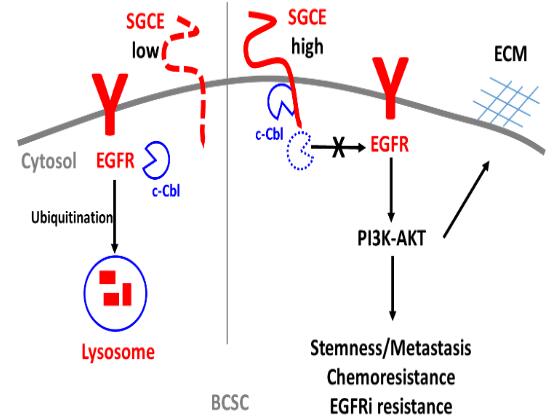
图1. SGCE通过调控EGFR而贡献于乳腺癌干细胞的自我更新
