

近日,中国科学院昆明动物研究所研究团队在新冠病毒感染促进神经病变的分子机制研究方面取得新进展。研究成果以“SARS-CoV-2 Spike protein S2 subunit modulates γ-secretase and enhances amyloid-β production in COVID-19 neuropathy”为题,发表在国际期刊Cell Discovery上。
新冠疫情肆虐全球,已造成严重的公共卫生危机。新冠病毒早期主要侵染呼吸道上皮细胞,复制产生大量子代病毒粒子,导致肺等器官发生一系列病理损伤和炎症反应,包括急性肺损伤、急性呼吸衰竭、急性呼吸窘迫综合征(ARDS)等。由于疫苗大规模接种,目前新冠危重病例与死亡人数都大大减少,但越来越多的研究也发现,新冠病毒能够感染人体其它重要器官组织,特别是在感染中后期,系统炎症与局部感染联合诱发多器官免疫紊乱。随着新冠疫情进入后新冠时期,新冠感染相关后遗症(Long COVID)如肺和肾的纤维化、神经症状等,是人们极为关注的健康问题。
神经退变是新冠病毒感染的主要后遗症之一。由于遗传背景、年龄、毒株差异、免疫状态、取样时间点等变量因素,新冠病毒能否侵染中枢神经、新冠感染与神经症状相关性程度等问题存在有争论。但目前来自动物感染模型、类脑器官、临床脑组织样本分析等方面的研究结果,都提示新冠病毒可跨过血脑屏障,感染神经细胞,并导致神经病变。最近的新冠患者脑组织单细胞测序分析发现,尽管脑组织样本检测不到新冠病原,但仍出现神经炎症、神经细胞功能异常等病理特征。这些前人的研究结果提示,新冠病毒外周或中枢侵染对神经系统生理稳态和免疫监视功能有长期影响,是一个不容忽视的重要问题。近期的临床观察、实验证据、人群队列分析等研究还发现,新冠患者尸检脑组织出现神经退行性病变的经典病理标志物如β淀粉样蛋白(amyloid-β, Aβ)和过度磷酸化Tau蛋白的异常积累,新冠感染患者脑结构发生变化,新冠住院患者血清的神经变性标志物水平升高,认知能力出现下降。这些临床和实验结果,带来一系列的科学问题:新冠病毒感染造成神经细胞功能异常的生物学表型是什么?感染又是通过什么机制导致神经病变?对于这些科学问题的回答,有助于进一步理解冠状病毒感染-宿主互作机制以及感染致病机理,助力精准干预。
针对上述问题,来自中科院昆明动物所的曾健雄研究员、姚永刚研究员、张登峰研究员和国家昆明高等级生物安全灵长类动物实验中心(P3实验室)李明华高级工程师等发挥合作团队优势,集中进行了探索。他们首先对新冠病毒(SARS-CoV-2)感染30天后的人ACE2(hACE2)转基因小鼠的海马体进行转录组学分析,发现上调基因多与神经炎症以及衰老通路相关,而下调基因多富集在神经细胞功能通路,与淀粉样前体蛋白(amyloid precursor protein, APP)加工通路相关的基因如App、Psen1和Bace1等的表达水平则无显著变化,这提示新冠感染导致的Aβ异常积累可能不受转录水平的调控。考虑到APP经过包括γ-分泌酶(γ-secretase)在内的多种酶协同生化切割,产生Aβ,他们提出如下科学假设:新冠病毒可能通过蛋白水平机制调控γ-分泌酶,进而导致相关神经病变病理特征与症状。他们开展了一系列免疫共沉淀实验,结果显示新冠病毒的刺突蛋白(Spike)S2亚基能够与γ-分泌酶复合物结合,而刺突蛋白的S1亚基和新冠病毒膜蛋白不具有与γ-分泌酶复合物相结合的能力。利用多种细胞模型开展的功能性实验进一步发现,S2亚基可通过调节γ-分泌酶活性,进而促进Aβ产生。他们利用阿尔茨海默症小鼠模型(APP/PS1ΔE9小鼠),借助腺病毒相关病毒(AAV)递送系统,将S2亚基过表达在APP/PS1ΔE9小鼠的海马体,发现S2亚基过表达可显著加速阿尔茨海默症病理生物学标志如Aβ老年斑的形成,诱发神经炎症反应,从而导致神经细胞功能异常与神经退行性病变。
该项研究从分子机制、神经细胞、动物模型等层面,揭示了新冠病毒感染相关神经病变的分子机制。该研究结果为新冠感染加重神经退行性病变的临床干预,提供了科学依据和潜在靶标。
博士生马官芹、张登峰研究员、邹清翠助理实验师和谢小春助理实验师为该论文的共同第一作者,曾健雄研究员、姚永刚研究员和李明华高级工程师为论文的共同通讯作者。
该项工作依托中科院昆明动物所的国家昆明高等级生物安全灵长类动物实验中心开展,得到科技部、国家自然科学基金委、中科院、云南省等的资助。
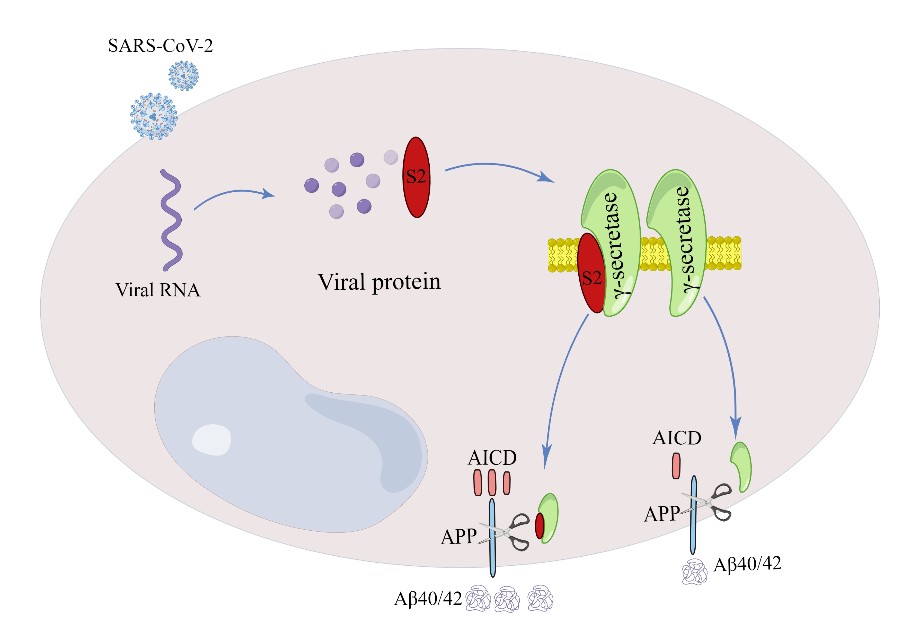
新冠病毒的刺突蛋白S2亚基调节γ-分泌酶活性,促进Aβ产生,加剧神经病变
