

随着遗传学研究的深入,与精神分裂症相关的风险变异不断被发现,但这些变异如何最终导致疾病,始终是领域内的核心谜题。中国科学院昆明动物研究所李明研究员团队与中南大学湘雅医院胡中华教授团队此前在Molecular Psychiatry期刊发表的综述指出,基因可变剪接很可能是连接遗传风险与疾病发生的关键桥梁。该综述同时指出一个严峻的挑战:目前对人脑转录组的注释仍不完整,极大限制了我们对精神分裂症致病机制的全面理解。许多可能与疾病相关的基因“剪影”仍隐藏在黑暗之中,如果仅局限于研究已经注释过的剪接异构体(Splice variant),会阻碍对精神分裂症疾病机制的全面理解。因此,进一步阐明这些剪接特征,是深刻理解疾病相关的大脑生理和病理,并将遗传学发现转化为全新治疗靶点的必经之路。

在此背景下,2026年1月16日,中国科学院昆明动物研究所李明团队与肖潇团队在Science Advances期刊发表最新研究(标题A causal coding variant regulating alternative splicing of DOC2A at 16p.11.2 GWAS locus influences susceptibility to schizophrenia),首次将精神分裂症的遗传风险锁定在一个由可变剪接产生、此前从未被注释的全新蛋白质上,并系统阐明了其驱动疾病的完整分子与行为学因果链条,实现了从遗传关联到机制解析的重要跨越。

研究基于人脑转录组数据,采用基于Junction count的创新分析策略,克服了传统方法仅能检测已知异构体的局限,系统识别出 1.7 万余个与精神分裂症相关的剪接信号,其中包含大量尚未被注释的可变剪接事件。通过精细筛选与实验验证,团队聚焦于 16p11.2 区域的一个同义突变 rs3935873。该变异并非沉默,而是充当了一个精准的“剪接开关”,特异性驱动 DOC2A 基因产生一个全新剪接异构体DOC2A∆Val217-Pro218,却不影响其全长转录本的表达。
rs3935873变异在人类中除增加精神分裂症发病风险,也与海马体积相关。为验证该新异构体的直接致病作用,研究团队在小鼠海马体中分别过表达DOC2A∆Val217-Pro218和全长DOC2A。结果显示,仅表达新型剪接体的小鼠出现显著的精神分裂症相关行为缺陷,而全长蛋白则无此效应,表明特定的剪接异常,而非基因本身的整体功能失调,是致病的关键。
进一步的机制研究表明,新型剪接体并非简单丧失原有功能,两种DOC2A蛋白异构体均会改变兴奋性突触传递。结构预测显示DOC2A∆Val217-Pro218具有与全长蛋白截然不同的三维构象,互作组学分析更揭示它结合了一套独特的分子网络,显著富集于肌球蛋白 II 复合物和锚蛋白结合等与细胞骨架及信号整合相关的通路,表明DOC2A∆Val217-Pro218并非简单地功能丧失,而是获得了全新的细胞功能,干扰了神经元内关键的功能模块,从而参与疾病发生。
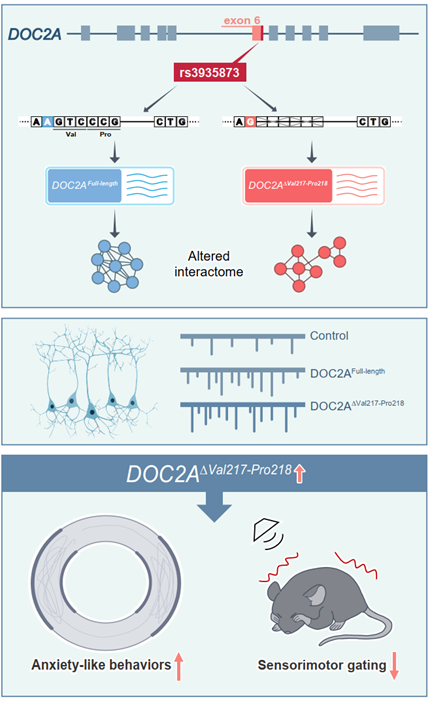
“这项研究不仅发现了一个全新的致病蛋白,更重要的是揭示了一类此前被忽略的致病机制:那些隐藏在基因组中、未被注释的剪接变异,可能通过产生新蛋白质驱动疾病。”李明强调,“如果我们只关注已知剪接异构体,将完全错过像 DOC2A 这样的关键信号。这为精神分裂症及其他复杂精神疾病的机制理解、精准干预与新药研发开辟了全新视角,未来我们或许可通过纠正异常的基因剪接来实现治疗。”
论文1通讯作者为中国科学院昆明动物研究所李明研究员和中南大学湘雅医院胡中华教授,第一作者为昆明动物研究所博士生张楚祎。文章链接:https://www.nature.com/articles/s41380-021-01037-w
论文2通讯作者为中国科学院昆明动物研究所李明研究员、肖潇研究员和蔡欣副研究员,第一作者包括昆明动物研究所博士生周丹阳、博士生张悦和博士后杨智辉。文章链接:https://www.science.org/doi/10.1126/sciadv.adw7667
上述研究工作依托“遗传进化与动物模型全国重点实验室”和“云南省动物模型与人类疾病机理重点实验室”等平台完成,并获得国家自然科学基金委、云南省科技厅和中国科学院等项目资助。
